Moin liebe Leserinnen und Leser,
heute möchte ich einmal allen mikroskopierfreudigen unter Ihnen einen praktischen Tipp geben.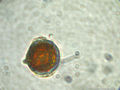
Der Dinoflagellat Protoperidinium sp. fixiert in Lugol bei 400-facher Vergrößerung.
Wer schon einmal versucht hat lebendes marines Zooplankton unter dem Mikroskop zu beobachten oder zu fotografieren, dem ist sicherlich aufgefallen wie schwer es ist ein einzelnes Tier zu fokussieren und dabei seinen schnellen Bewegungen zu folgen. Normalerweise werden für Bestimmungen oder Fotos die Proben mit Lugol’scher Lösung (Iod-Kaliumiodid-Lsg.) oder mit Formol fixiert, also abgetötet. Wer das allerdings umgehen möchte und nicht unnötig für seine Neugier Tiere töten möchte, dem sei hier eine Alternative ans Herz gelegt.
Während meiner Masterarbeit habe ich intensiv mit marinem Zooplankton gearbeitet. Dabei pflegte ich Kulturen von calanoiden Copepoden (Krebse/Hüperlinge) aus der Nordsee bei denen Fraßexperimente mit zwei verschiedenen Futterquellen in unterschiedlichen Relationen durchgeführt wurden. Um einen Effekt einer Futterart auf die Copepoden feststellen zu können musste die Eierproduktion der adulten Weibchen festgehalten werden. Dafür musste ich zunächst einmal die Weibchen von den Männchen trennen. Wie soll man einzelne Hüpferlinge aus ein paar Millilitern Wassers herausfangen, wenn sie ihrem Namen alle Ehre machen? Ganz einfach, man legt sie schlafen! Nach einiger Recherche wurde ich dann fündig.
Adultes Weibchen von Acartia tonsa aus der Nordsee betäubt mit der MgCl2-Lösung
Magnesiumchlorid (MgCl2*6H2O) wirkt bei einigen marinen Wirbellosen als Muskelrelaxanz. Dies gilt nachweislich bei Mollusken, also Schnecken, Muscheln und Kopffüßern als auch bei Krebstieren. Einzellige Organismen (Protozoa), wie zum Beispiel Cilliaten oder Dinaflagellaten betrifft dies nicht. Ich konnte beobachten, wie zwischen den betäubten Copepoden die einzelligen Futtertiere munter durch die Gegend schwammen. Diese Methode wird auch erfolgreich bei der Untersuchung von mariner Meiofauna eingesetzt. Meiofauna ist ein Begriff, der mikroskopisch kleine Tiere beschreibt, die zwischen den einzelnen Sandkörnern im Meeresboden leben. Dazu gehören neben vielen Kleinkrebsen auch Würmer, wie Polychaeten, Oligochaeten und Plattwürmern.
Für meine Versuche wählte ich eine 7,5%ige MgCl2-Lösung in Aquadest nach Messenger et al. 1985. Es ist darauf zu achten, dass man nicht zuviel der Betäubungs-Lösung zum Originalwasser dazugibt um die Tiere nicht durch eine zu starke Betäubungswirkung zu töten. Wie bei jeden Anästhetikum gibt es eine lethale Obergrenze oder besser einen „Point of no return“. Die Betäubungslösung ist etwa 1:1 vorsichtig mit dem Probenwasser zu vermengen.
Vorbereitung der Narkose - Links oben: gefiltertes Seewasser (0,2 µm) zur Verdünnung; links unten: Mundpipette für das Herausfangen einzelner Tiere; Mitte: Mikroskopierplatte mit 6 Einzelkammern (BD Falcon ™ 6-well Multiwells™); rechts oben: Magnesiumchlorid-Hexahydrat; rechts unten: Petrischale für die Narkose.
Vorbereitung der Narkose – Links oben: gefiltertes Seewasser (0,2 µm) zur Verdünnung; links unten: Mundpipette für das Herausfangen einzelner Tiere; Mitte: Mikroskopierplatte mit 6 Kammern (BD Falcon ™ 6-well Multiwells™); rechts oben: Magnesiumchlorid-Hexahydrat; rechts unten: Petrischale für die Narkose.
Es dauert etwa 15 Minuten bis dann endlich Ruhe einkehrt. Mikroskopieren Sie Kleinkrebse, wie Copepoden, so können Sie sich von deren Leben am regelmäßigen Herzschlag überzeugen. Auch nach einer etwa zweistündigen Narkose konnten die Tiere durch eine Spülung mit Original-Seewasser wieder langsam aufgeweckt werden. Es konnten keine Verluste festgestellt werden.
Wie schon erwähnt ist diese Methode nur für marine Lebewesen geeignet. Süßwasserorganismen würden einen Osmoseschock erleiden und verschrumpeln. Für limnische Tiere (auch Einzeller) ist eine kurzfristige Betäubung mit kohlensäurehaltigem Mineralwasser gängige Praxis. Im Untersuchungswasser wird durch die Zugabe von Kohlensäure der CO2-Gehalt schlagartig erhört, da Kohlensäure sofort dissoziiert. Das kann jedoch ab einer gewissen Konzentration irreversibel sein, so dass die Organismen absterben. Uns würde es nicht anders ergehen.
Meine aussortierten Copepoden-Männchen konnte ich auf diese Weise wieder lebendig in den Kulturentank zurückgeben. Auch die Weibchen wurden nach Beeindigung des Experimentes wieder zurückgeführt. Ich finde es wichtig, dass wenn man sich mit lebenden Tieren beschäftigt und seien sie noch so klein und für viele auch unbedeutend, man immer mit dem nötigen Respekt vor der Kreatur agiert …
Weiterführende Literatur:
MESSENGER, J.B., NIXON, M., RYAN, K.P. (1985): Magnesium Chlorid as an anaesthetic for cephalopods; Comp. Biochem. Physiol. Vol. 82C, No.1, pp. 203-205
Links:
KRAMER, M., HOLST, M., NEUMANN, R. (2006): Bericht über das Vertiefungspraktikum Systematik und Ökologie mariner Meiofauna
Copyright Text und Bilder: Christopher Joest oder aber bei Facebook








